文献解读
Nature Communications | 短链脂肪酸–戊酸盐通过调节淋巴细胞代谢抑制自身免疫
短链脂肪酸(SCFAs)如乙酸盐、丙酸盐、丁酸盐是由肠道细菌发酵膳食纤维产生的。可溶性微生物因子(如SCFAs)在生理上是连接共生菌群和粘膜免疫系统的重要信号。SCFAs具有诱导结肠调节性T细胞(Tregs)分化和增强肠道屏障功能的作用。SCFAs不仅可以预防粘膜炎症和结直肠肿瘤的发生,还可以系统性地改善大脑T细胞驱动的自身免疫和肺过敏性哮喘。SCFAs通过增加肠上皮细胞的完整性、特异性抗体反应和结肠Treg的数量来促进机体处于稳定健康状态,但它们也有可能促进上皮细胞或T淋巴细胞介导的炎症反应。有关戊酸盐来源及免疫调节作用机制知之甚少,德国马尔堡大学Alexander Visekruna研究团队主要探讨短链脂肪酸-戊酸盐对炎症和自身免疫性疾病的治疗作用,相关研究成果发表于《NATURE COMMUNICATIONS》。(文末有下载原文方式)
戊酸盐抑制IL-17A的产生
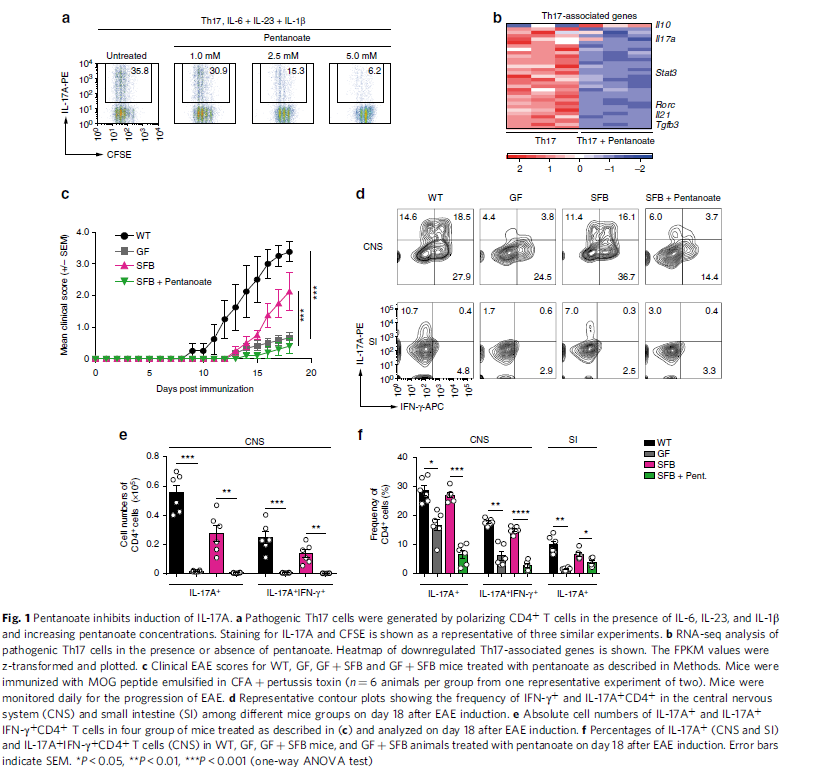
肠道SCFAs丰度检测显示,与GF小鼠相比,野生型小鼠除了检测到乙酸、丙酸、丁酸外,还检测到戊酸,但戊酸的含量低于其他三种。为了探索戊酸的潜在治疗能力,采用IL-6 + IL-23 + IL-1β组合诱导致病性Th17细胞,戊酸盐处理后能有效抑制Th17淋巴细胞的增殖及IL-17A的产生(图1a)。RNA-seq分析显示戊酸盐处理可上调IL10的表达,下调包括Rorc、Il21、Stat3在内的大部分Th17相关基因(其中主要为Tgfb3,由致病Th17细胞产生)(图1b)。TGF-β3通过上调IL-23受体维持Th17细胞的致病表型。在实验性自身免疫性脑脊髓炎(EAE)过程中,Th17细胞属于中枢致病性T细胞群,参与中枢神经系统(CNS)自身免疫性炎症的发展,高致病性Th17细胞的发育对EAE的恶性进展至关重要。
作者采用FIR× tiger小鼠诱导EAE,以探究戊酸盐是否能调节CNS的炎症反应。戊酸盐可改善EAE的严重程度,减少CNS中CD4+, CD8+T细胞浸润的数量,并在CD4+, CD8+T细胞中表现出低频率的IL-17A+和IFN-γ+ IL-17A+细胞。之前有报道过IL-17A+ 和IFN-γ+ Treg存在于发炎的CNS中,质疑它们在这种高度炎症的环境中的抗炎特性。作者发现在EAE进展过程中,FIR× tiger小鼠发炎的CNS中存在显著差异的Foxp3+ (RFP+)Treg共表达IFN-γ和IL-17A。尽管体内戊酸盐治疗没有改变CNS中Tregs的频率,但它强烈降低了Foxp3+ Treg群体中IL-17A+和IFN-γ+ IL-17A+细胞的比例。
接下来,作者测试了戊酸盐可能在非致病菌免疫系统相互作用的背景下抑制肠道Th17细胞的生成,从而调节小鼠EAE的进展。分节丝状菌(SFB,一种哺乳动物的共生肠道细菌)可诱导小鼠小肠Th17细胞的增殖。虽然GF小鼠对EAE发展具有高度抗性,但这些动物用SFB单核化诱导致病性Th17反应并促进CNS炎症(图1c, d)。戊酸盐处理SFB-单定植的GF小鼠显著改善EAE并导致CNS中Th17细胞的数量和频率降低(图1c-f)。
戊酸盐诱导效应T细胞IL-10表达
作者测试了小鼠在各种SCFAs存在下的CD4+ T淋巴细胞组蛋白去乙酰化酶(HDAC)活性,探索戊酸盐是否能够调节HDACs活性,结果显示丁酸盐、戊酸盐和丙酸盐对HDAC有较强的抑制作用,乙酸盐和己酸盐几乎没有HDAC抑制作用(图2a)。戊酸盐有效抑制HDAC活性可降低IL-17A表达,用pan-HDAC抑制剂曲古抑菌素A(TSA)处理Th17细胞也引起相似作用(图2b),但作者观察到TSA不能诱导FIR× tiger小鼠Th17细胞产生IL-10 (GFP+)。为了探讨SCFA介导的代谢改变是否能调节促炎细胞因子和抗炎细胞因子之间的平衡,在2-脱氧葡萄糖(2-DG,糖酵解抑制剂) 存在的情况下,研究戊酸盐对Th17细胞中IL-17A和IL-10同时表达的影响。戊酸盐刺激Th17细胞后,IL-10+ (GFP+ )细胞的频率明显增加,与2-DG共处理后,完全阻断了戊酸盐诱导的IL-10,提示戊酸盐使得糖酵解作用增强,但对HDAC抑制作用不明显(图2b-d)。此外,作者发现戊酸盐处理的Th17细胞细胞外酸化速率(ECAR)增加,糖酵解活性增强(图2e)。因此,戊酸盐(增加IL-10表达)及其抑制HDAC活性(降低IL-17A表达)介导的糖酵解的增强,导致Th17细胞的代谢、表观遗传重编程和致病表型的丢失。
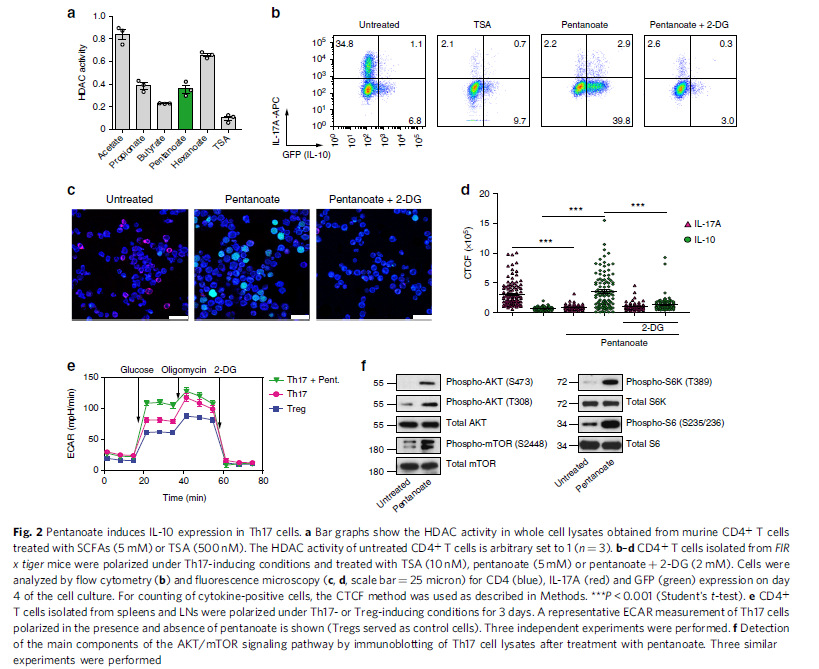
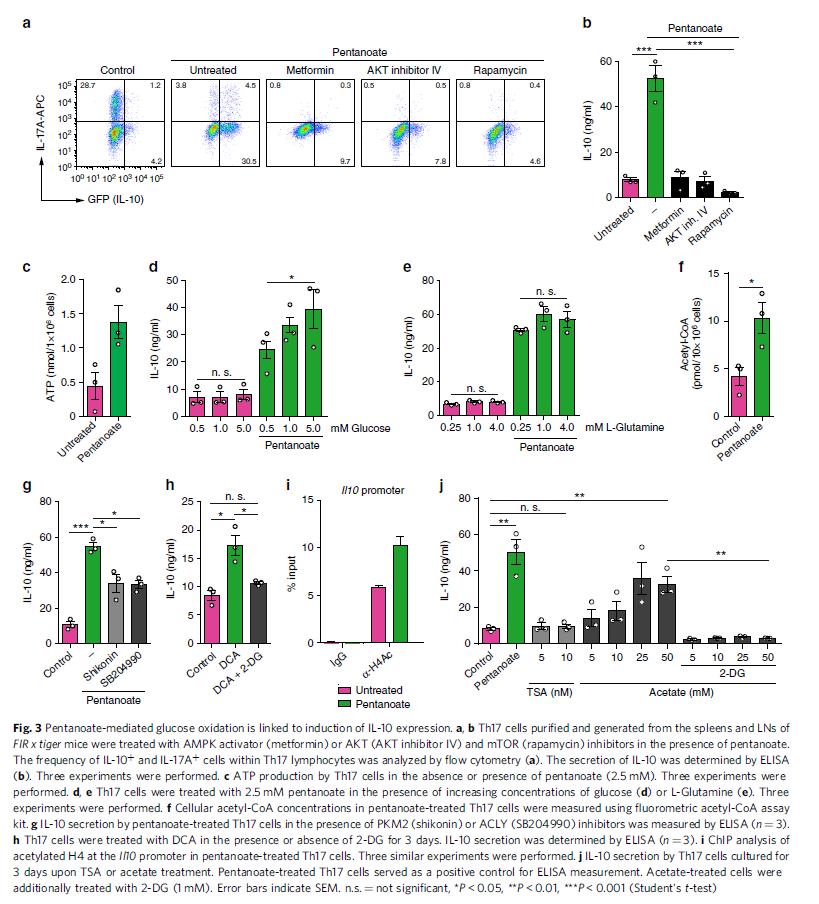
AKT/mTOR信号通路是细胞进程中细胞对环境信号作出反应的重要调控因子,能控制癌细胞和其他细胞的糖酵解代谢。戊酸盐是否能够增加Th17细胞中mTOR复合物的活性?用戊酸盐处理Th17细胞后,mTOR及其靶分子的活性均增强(图2f)。AMP活化蛋白激酶(AMPK)活化可阻断mTOR通路的激活。因此,通过雷帕霉素或AKT抑制剂IV抑制AKT/mTOR信号通路,二甲双胍激活AMPK,可显著抑制经戊酸盐处理的Th17细胞中IL-10的产生(图3a, b)。此外,戊酸盐处理Th17淋巴细胞后,细胞ATP水平显著升高(图3c),推测戊酸盐可能通过提高ATP水平和消耗细胞中的AMP来抑制AMPK活性。
在谷氨酰胺存在下,仅用戊酸盐处理而不控制Th17细胞,葡萄糖补充后可增加IL-10的生成(图3d)。葡萄糖存在下,增加谷氨酰胺浓度并不能进一步增加IL-10的分泌(图3e)。这些数据表明,戊酸盐介导的糖酵解代谢增强促使Th17细胞中IL-10的表达增加,而这并非由谷氨酰胺代谢导致。由于戊酸盐处理后的Th17细胞乙酰辅酶A浓度明显升高(图3f) ,推测戊酸盐可能转化为乙酰辅酶A。最近,由ATP柠檬酸裂解酶(ACLY)介导的糖酵解经丙酮酸氧化和随后柠檬酸转化为乙酰辅酶A,被证明对于记忆CD8+T细胞中IFN-γ的快速产生至关重要。
紫草素(丙酮酸激酶-M2的抑制剂)和SB204990 (ACLY的抑制剂)的抑制导致由戊酸盐处理的Th17细胞IL-10的分泌减少(图3g)。同样,通过抑制丙酮酸脱氢酶激酶(PDHK),用二氯乙酸(DCA)激活丙酮酸脱氢酶(PDH),将葡萄糖代谢从生成乳酸的需氧糖酵解转移到丙酮酸氧化,即使在没有戊酸盐的情况下,也会导致Th17细胞IL-10的生成升高。通过在细胞培养物中添加2-DG可以逆转IL-10的升高(图3h)。2-DG的存在导致Th17细胞分泌的乙酸盐介导的IL-10被阻断,有力的支持了2-DG对IL-10的逆转作用(图3j)。
戊酸盐诱导B细胞上调IL-10分泌
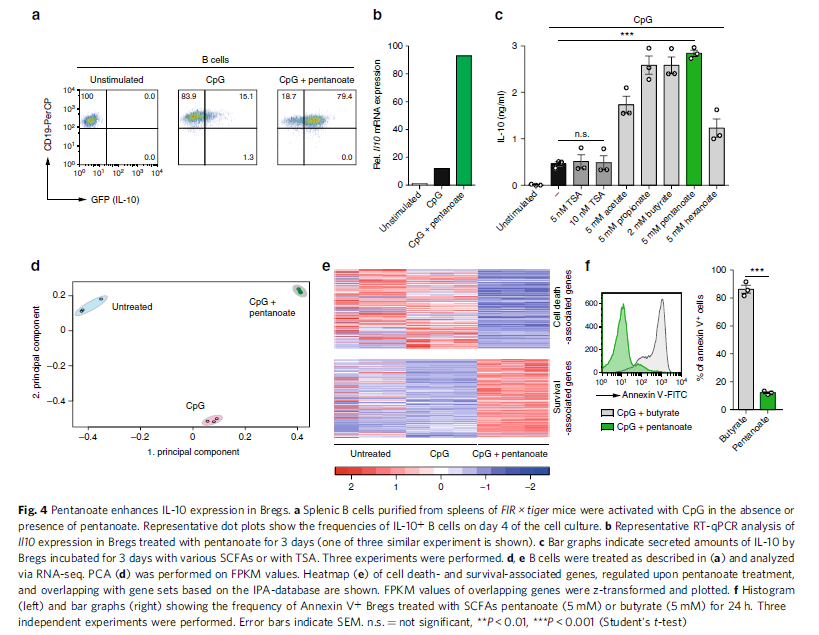
SCFA治疗是否会影响调节性B细胞(Bregs)产生IL-10。用CpG或LPS(Bregs)刺激脾B细胞,当戊酸存在的情况下,Bregs中IL-10表达增强(图4a,b),而TSA不能显著增加Bregs中IL-10的分泌(图4c)。接下来对CpG诱导的Bregs进行RNA-seq,主成分分析揭示了对照组和戊酸盐处理组之间Bregs存在显著差异(图4d)。对戊酸盐组调控的基因进行超几何富集分析,发现戊酸盐处理后,凋亡相关基因下调,而促生存相关基因上调(图4e)。膜联蛋白V+凋亡细胞的流式细胞术显示戊酸盐是唯一一种不仅能够增加IL-10分泌,而且还能显著抑制Bregs细胞凋亡的SCFAs。为了研究戊酸盐对体内Bregs功能的影响,将初始CD4+T细胞单独或联合戊酸盐处理的Bregs过继转移到Rag1缺陷小鼠体内。用初始T细胞重组的小鼠在第50天出现进行性体重减轻和结肠炎发展,而戊酸盐处理的Bregs转移组,体重减轻得到抑制,免疫病理学得到改善,结肠固有层和肠系膜淋巴结(mLN) CD4+效应T细胞数量减少,这些数据表明戊酸盐将可能被用于稳定Bregs抑制表型的治疗。
戊酸盐处理的Bregs抑制小鼠EAE的发育
在B细胞中,p38丝裂原活化蛋白激酶(MAPK)信号通路活化可诱导IL-10表达。在p38抑制剂SB203580浓度增加的情况下,用CpG和戊酸盐处理Bregs,阻断p38激酶活化,戊酸盐诱导的Bregs仍能在一定程度上生成IL-10,说明在戊酸盐介导的Bregs调控中还涉及其他机制(图5a)。有趣的是,戊酸盐处理后发生改变的许多基因与代谢途径有关,对有或无戊酸盐时CpG刺激的Bregs的ECAR,戊酸盐处理组增加了Bregs的糖酵解和糖分解能力(图5b),催化糖酵解限速酶己糖激酶2的表达增强(图5c)。用2-DG处理后,戊酸盐介导的Bregs中IL-10表达上调被抑制。同时抑制糖酵解和阻断p38 MAPK活化几乎可以完全消除Bregs中戊酸介导的IL-10生成。有趣的是,只有使用CpG和戊酸盐治疗的Bregs,而不是单独使用CpG刺激的Bregs,在葡萄糖补充增加后,IL-10的分泌增加。与PDHK抑制剂DCA共孵育Bregs可促进葡萄糖氧化,增加IL-10的生成,而与DCA和2-DG共孵育细胞IL-10水平降低。与Th17细胞类似,戊酸盐处理Bregs可导致AKT和mTOR磷酸化以及mTOR复合物1的下游靶点(如S6K, S6)水平升高(图5d)。特异性抑制剂阻断mTOR上游的信号分子如PI3K(wortmannin),PDK1(GSK2334470)和AKT(AKT抑制剂IV)可显著抑制戊酸盐处理的Bregs中 IL-10的生成(图5e,f)。
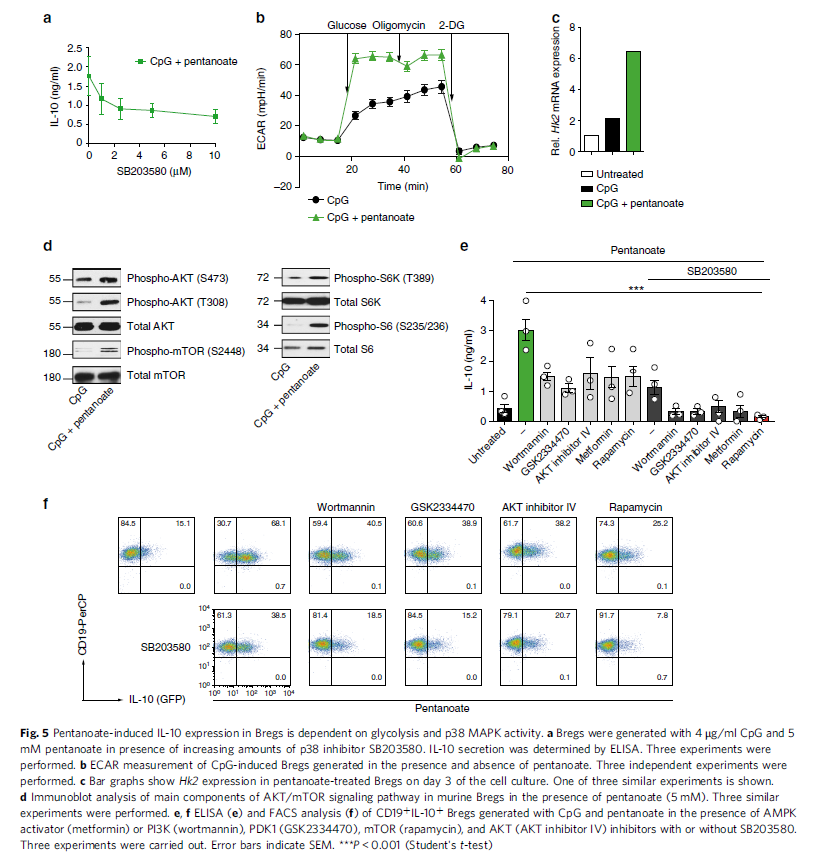
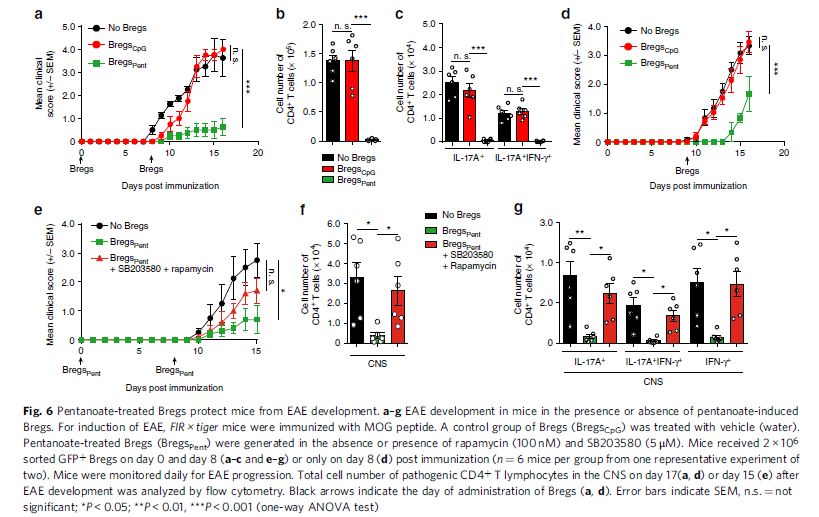
mTOR和p38 (SB203580)联合抑制戊酸盐诱导的Bregs的IL-10的产生,细胞大小减小 (图5e-f)。LPS或CpG诱导的2×106 Bregs转移通常不会抑制小鼠EAE的发生,这可能是由于它们具有较强的促细胞凋亡能力。为了分析戊酸盐诱导的Bregs在体内是否能够抑制自身免疫反应, 复制WT小鼠EAE模型,并在接种戊酸盐后第0天和第8天(预防组)或仅在第8天(治疗组)接种戊酸盐后移植2×106 个Bregs。未接受治疗的小鼠及接受载体Bregs治疗的动物表现出强烈的EAE症状:四肢麻痹和免疫细胞浸润到CNS。接受戊酸盐处理的Bregs小鼠由于CNS中缺乏浸润的致病性淋巴细胞而没有表现出自身免疫疾病的临床症状(图6a-d)。为了测试mTOR复合物和p38 MAPK对戊酸盐处理的Bregs抑制能力的影响,随后将mTOR和SB203580存在时产生的Bregs转移到小鼠体内,其中EAE模型由MOG肽诱导。尽管Bregs因戊酸盐存在抑制CNS的自身免疫性疾病,而这些细胞经mTOR/p38 MAPK抑制剂预处理后,对EAE的保护能力显著降低(图6e,g)。上述发现揭示戊酸盐在改善分泌IL-10的Bregs抑制活性中发挥重要作用,将成为未来潜在的治疗方法。
小结
膳食纤维依赖性SCFAs对慢性炎症的有益作用众所周知,但戊酸盐可能更适合诱导抗炎反应,因为它比丁酸盐毒性更小,比乙酸盐更有效。本研究探索了戊酸盐是否能够调节淋巴细胞的代谢途径,从而对炎症和自身免疫性疾病产生治疗作用。揭示戊酸引起B细胞和CD4+效应T淋巴细胞代谢重新分布,导致糖酵解、丙酮酸氧化和免疫调节细胞因子IL-10分泌增加。有趣的是,戊酸盐虽然具有很强的HDAC抑制活性,却不能增强粘膜Treg的扩张。戊酸盐的抗炎作用不仅体现在Bregs和CD4+效应T细胞中IL-10显著上调,还表现在对致病性Th17细胞表型的有效抑制。通过使用各种特异性代谢活性酶抑制剂,发现戊酸盐依赖的IL-10分泌通过mTOR活性增强、葡萄糖衍生的丙酮酸氧化和乙酰辅酶A产量的增加实现。在Th17细胞中,戊酸对淋巴细胞的代谢和表观遗传状态存在两种不同的影响,一方面糖酵解速率增加和丙酮酸氧化诱导IL-10生成,ACLY的阻断导致IL-10分泌减少;另一方面戊酸盐的HDAC抑制活性主要抑制IL-17A的表达,它们共同改善了这些细胞的抗炎能力。
综上,戊酸盐通过T淋巴细胞和B淋巴细胞的代谢和表观遗传重编程发挥其免疫调节作用,鉴于代谢和表观遗传调节和抗炎免疫反应之间的平衡,戊酸盐能够改善小鼠肠和脑中T细胞介导的免疫病理学。肠道微生物代谢产物戊酸盐可能作为一种低成本且耐受性良好的潜在药物,用于多发性硬化症和其他TH17介导的自身免疫性疾病的治疗,未来更需要研究戊酸盐的临床治疗潜力。
参考文献
Maik Luu, Sabine Pautz, Alexander Visekruna, et al. The short-chain fatty acid pentanoate suppresses autoimmunity by modulating the metabolicepigenetic crosstalk in lymphocytes. Nature Communications (2019)10:760. https://doi.org/10.1038/s41467-019-08711-2.
原文下载,请长按识别下方二维码

精彩回顾
2. 科研 | Nature:乙酸盐通过介导微生物-脑-β细胞轴促进代谢综合征
3. Cirulation | 短链脂肪酸–丙酸盐预防高血压心血管损害
4. GUT | 丁酸盐通过肠-脑神经回路降低食欲并激活棕色脂肪组织
5. Nature Reviews Endocrinology | 肠道微生物代谢产物对肥胖、NAFLD和T2DM的影响



