文献解读
Cell 重磅揭秘 | 56种菌源新型胆汁酸角逐@谁能奏响AR拮抗剂+抑瘤+强抗PD-1疗效三重奏?
初级胆汁酸进入肠道后,经微生物群代谢转化为次级胆汁酸,近年的研究表明,这些次级胆汁酸可通过激活宿主细胞表面的特定受体来调节宿主基因表达、炎症反应及能量代谢过程。但胆汁酸存在大量的同分异构体,且部分胆汁酸含量偏低,这些特点使得针对它们的功能表征困难重重,因此这些新型胆汁酸成为亟需被发掘的活性小分子宝库。
雄激素受体(AR)作为核受体超家族的重要成员,主要被雄激素(如睾酮)激活。在病理状态下,AR是前列腺癌发生发展的关键驱动因子,针对AR信号通路的内分泌治疗(如雄激素剥夺疗法)已成为前列腺癌的一线治疗策略,但进一步的分子调控机制还待研究。
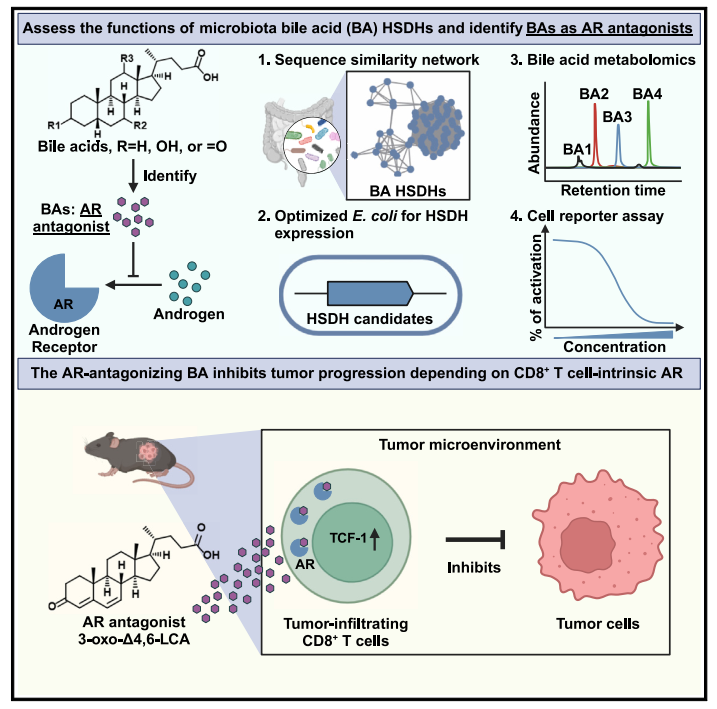
2025年4月,美国康奈尔大学的郭春君团队在Cell上在线发表题为Microbiota-derived bile acids antagonize the host androgen receptor and drive anti-tumor immunity的研究论文,针对207个潜在的微生物胆汁酸羟类固醇脱氢酶(HSDH)开展功能解析,成功鉴定出56种此前未被充分表征的新型胆汁酸。进一步研究发现,其中一类胆汁酸可作为强效雄激素受体(AR)拮抗剂,代表性胆汁酸3-oxo-D4,6-LCA具有抑制肿瘤生长与转移,并显著增强抗PD-1免疫检查点疗法的抗肿瘤疗效。
技术路线
研究结果
1.发现新型胆汁酸异构体
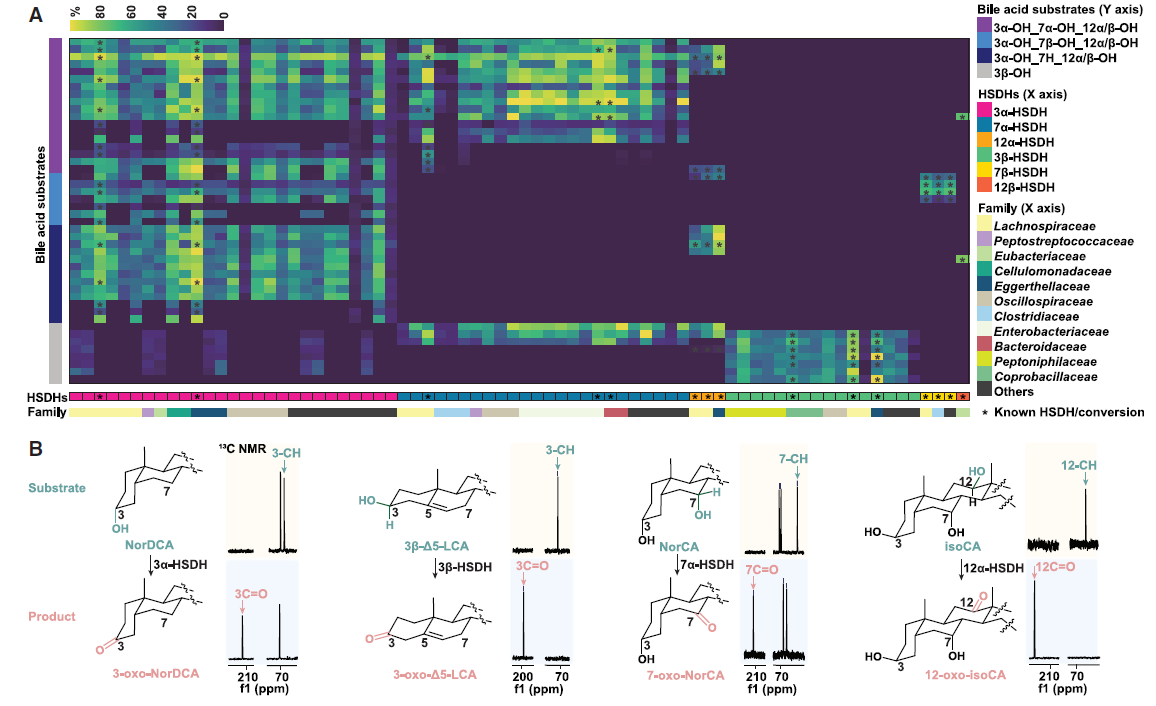
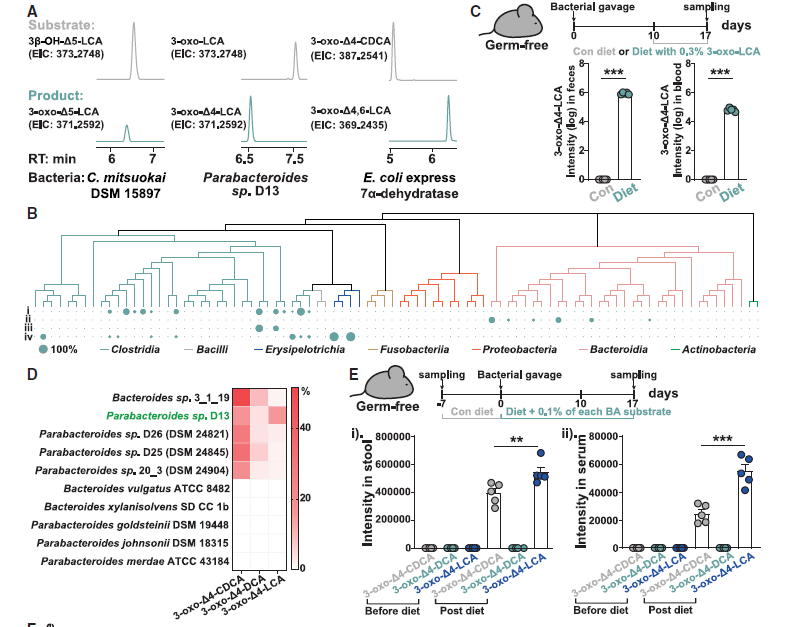
首先,研究者建立了一个包含62种已知胆汁酸标品的物质库,在对人源和鼠源的粪便进行代谢组学分析时发现了一些与已知胆酸保留时间不同的未知质谱峰,进一步用同位素标记的胆汁酸体外培养粪便菌群,鉴定出了多个特征不明确的新型胆汁酸,为已知胆汁酸的同分异构体。
2.新型胆汁酸异构体的鉴定和特征
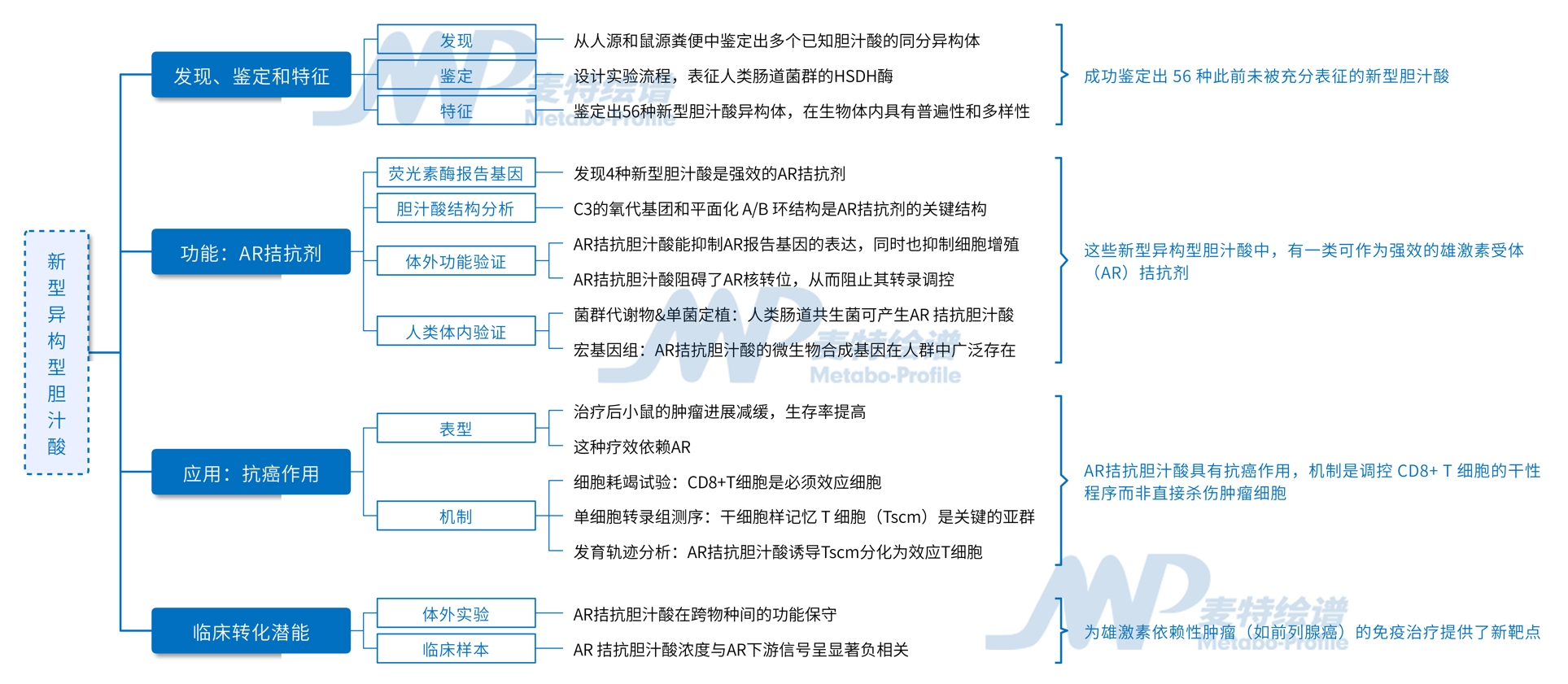
接下来,作者推测这些新型胆汁酸的结构可变部分由微生物群的胆汁酸羟基类固醇脱氢酶(HSDHs)驱动 ,并基于此设计了一套实验流程,用以表征人类肠道菌群中的HSDH。
• 首先对UHGP/UMGP-90数据库的HSDH候选基因进行序列相似性网络(SSNs)构建,从中随机选择207个基因(含15个已报道基因),由强启动子Pnifj驱动表达。
• 然后对大肠杆菌进行基因优化后作为表达宿主,分别导入候选基因后,在培养基中添加胆酸、3-氧代胆酸等底物,以鉴定出具有胆汁酸HSDH活性的基因。
• 最后在具有功能性HSDH的大肠杆菌培养基中分别添加46种胆汁酸标准品作为底物,通过LC-MS检测转化后的胆汁酸,以匹配这些HSDH的功能。
图1. 微生物群HSDHs和新型胆汁酸异构体的研究流程
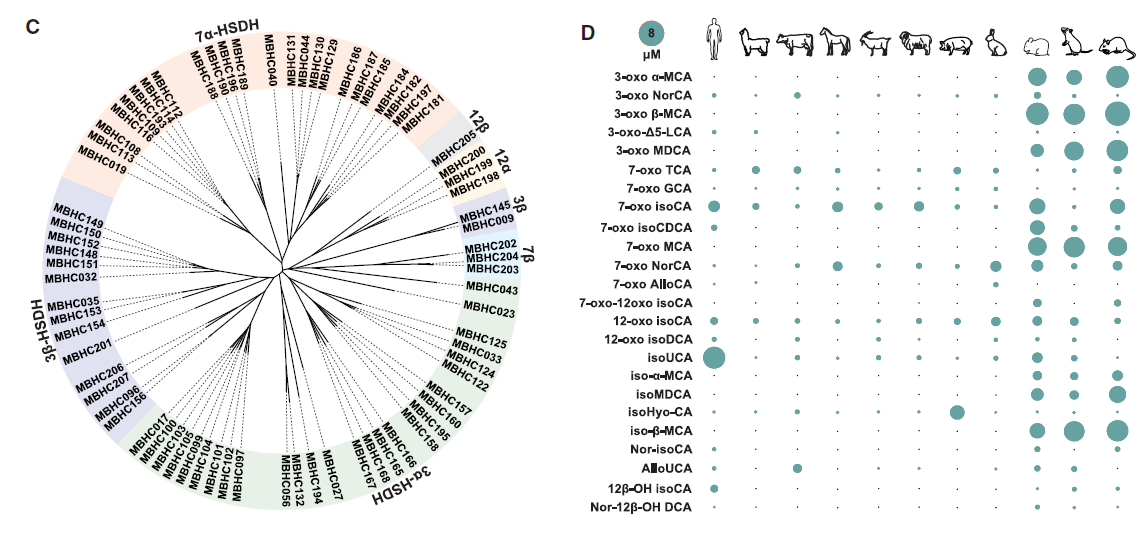
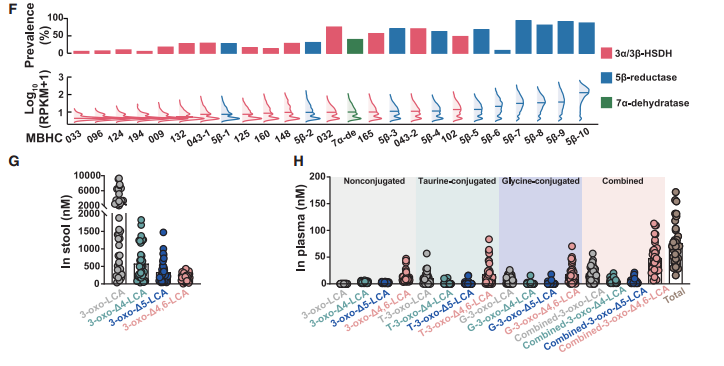
基于上述方法,研究者筛选出了74种具有活性的胆汁酸HSDHs基因,并鉴定出56种新型胆汁酸异构体,随后通过靶向代谢组学检测,确定了这56种胆汁酸异构体在人类和其他哺乳动物粪便样本中广泛存在,且不同物种具有独特的胆汁酸指纹图谱,即这些特殊胆汁酸在生物体内具有普遍性和多样性。
图2. 肠道微生物群中的HSDHs及其生成的新型胆汁酸异构体
3.新型胆汁酸异构体的功能:AR拮抗剂
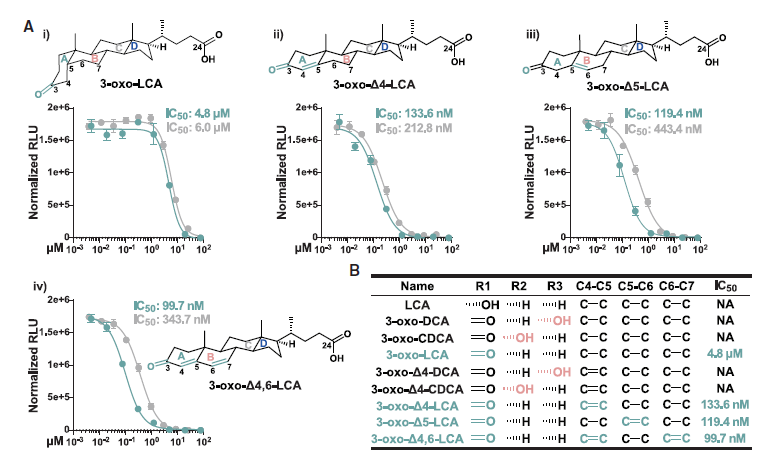
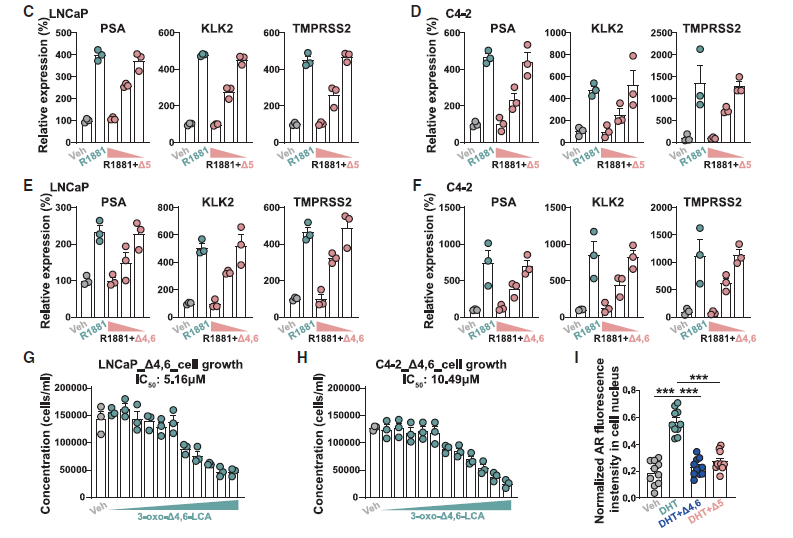
已知胆汁酸是FXR、LXR等受体的配体,但其是否与其他类固醇受体(如雄激素受AR)互作尚不明确。由于胆汁酸具有类固醇骨架,推测其可能与AR等受体结合,介导未知的宿主信号通路。基于这一理论基础,研究者对56种新型异构型胆汁酸逐一进行了荧光素酶报告基因检测,从中发现了以3-oxo-D5-LCA为代表的4种强效AR拮抗剂,蛋白竞争性试验则进一步说明这4种胆汁酸可直接结合AR配体结合域(LBD),表明其拮抗活性源于物理结合。
此外,研究者还在分子水平、细胞功能和作用机制3个层面进行了验证,发现AR拮抗胆汁酸可下调AR依赖性基因的表达,同时也会抑制细胞增殖。就分子机制而言,这些AR拮抗胆汁酸阻碍了AR从细胞质转移到细胞核(核转位),从而阻止其调控基因转录。
图3. 胆汁酸拮抗人类雄激素受体(hAR)
最后,研究者通过菌群代谢物检测、单菌定植等实验证实,人类肠道共生菌可产生上述AR拮抗胆汁酸;宏基因组分析也显示,这些胆汁酸对应的微生物合成基因在健康人群中广泛分布。
图4. AR拮抗胆汁酸可由人类肠道菌群衍生而来
4.AR拮抗胆汁酸可抑制肿瘤生长和转移
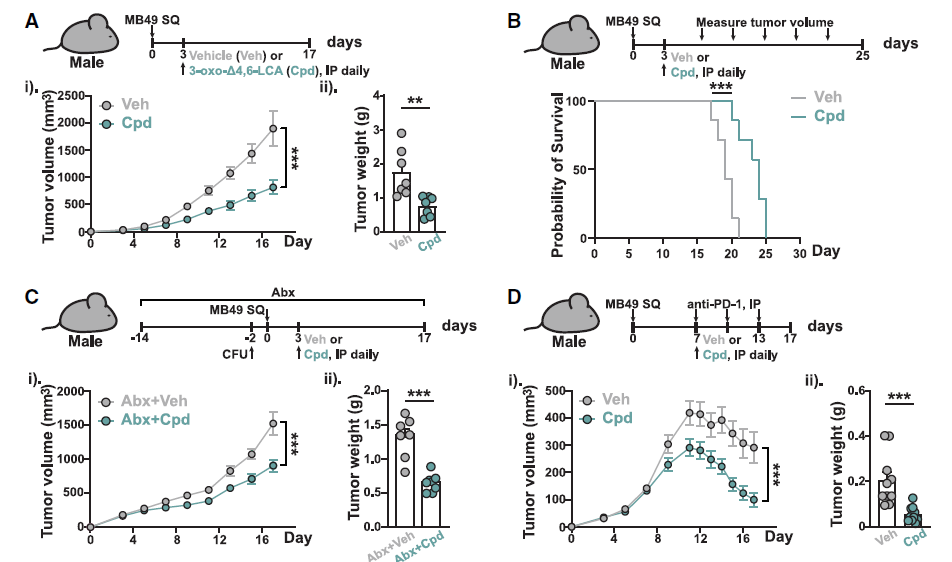
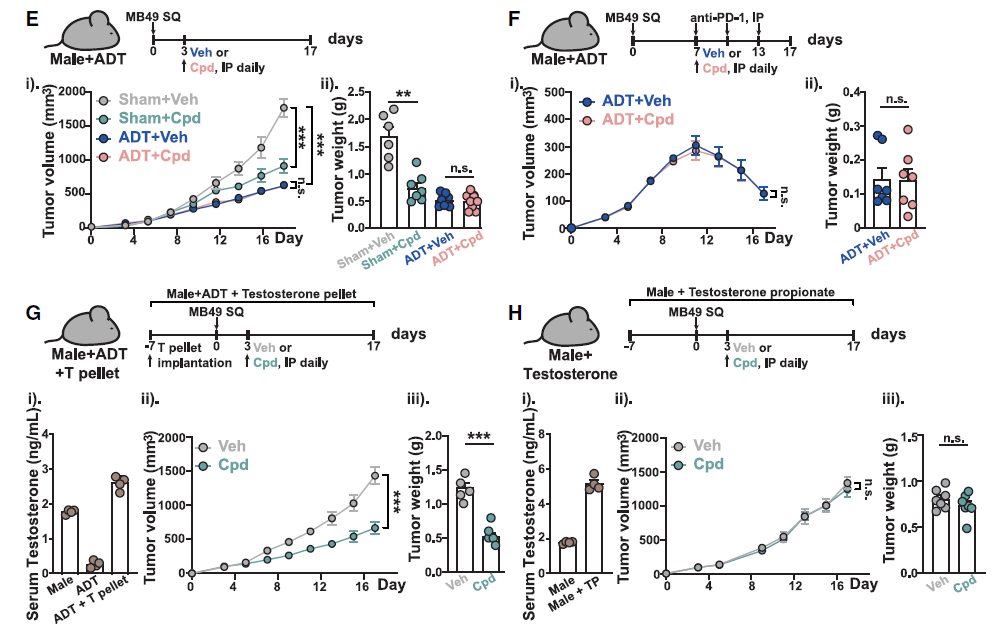
已有研究表明,AR信号会下调抗肿瘤免疫和免疫检查点阻断疗法的疗效。基于此,研究者推测AR拮抗胆汁酸在体内能够减轻肿瘤负担并介导抗肿瘤免疫,并选择3-oxo-D4,6-LCA进行相关研究。
首先对荷瘤小鼠腹腔注射3-oxo-D4,6-LCA,观察到肿瘤的进展和转移显著减缓,且小鼠生存率延长;但当剥夺小鼠的雄激素来源(ADT)后这些效应消失,此时补充生理水平睾酮又可恢复疗效。这些数据表明3-oxo-D4,6-LCA 以依赖AR的方式抑制肿瘤进展并增强抗PD-1治疗的疗效。
图5. AR拮抗胆汁酸以依赖雄激素受体的方式促进抗癌免疫
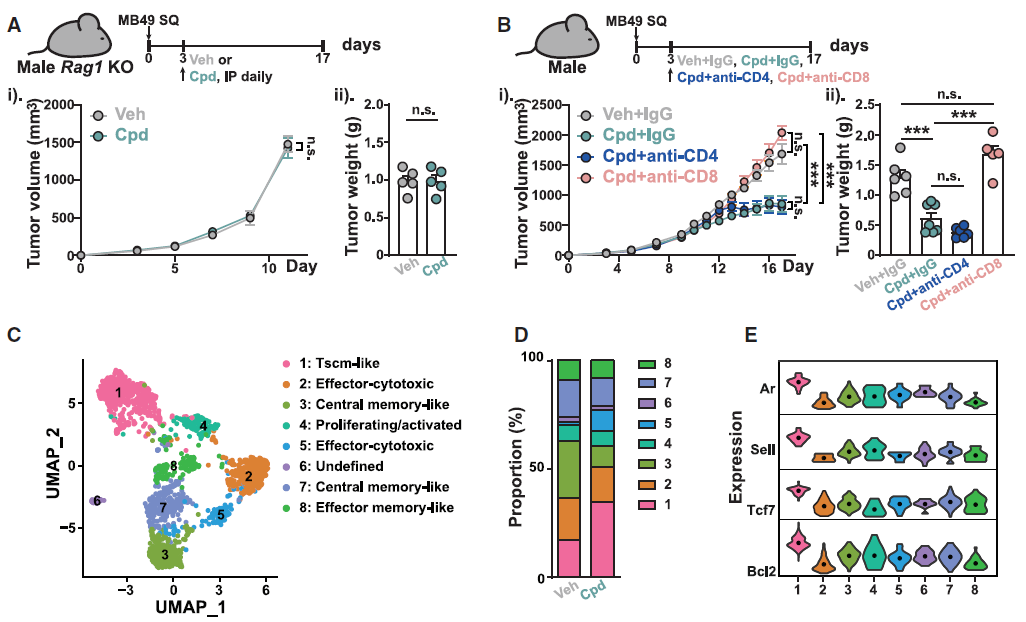
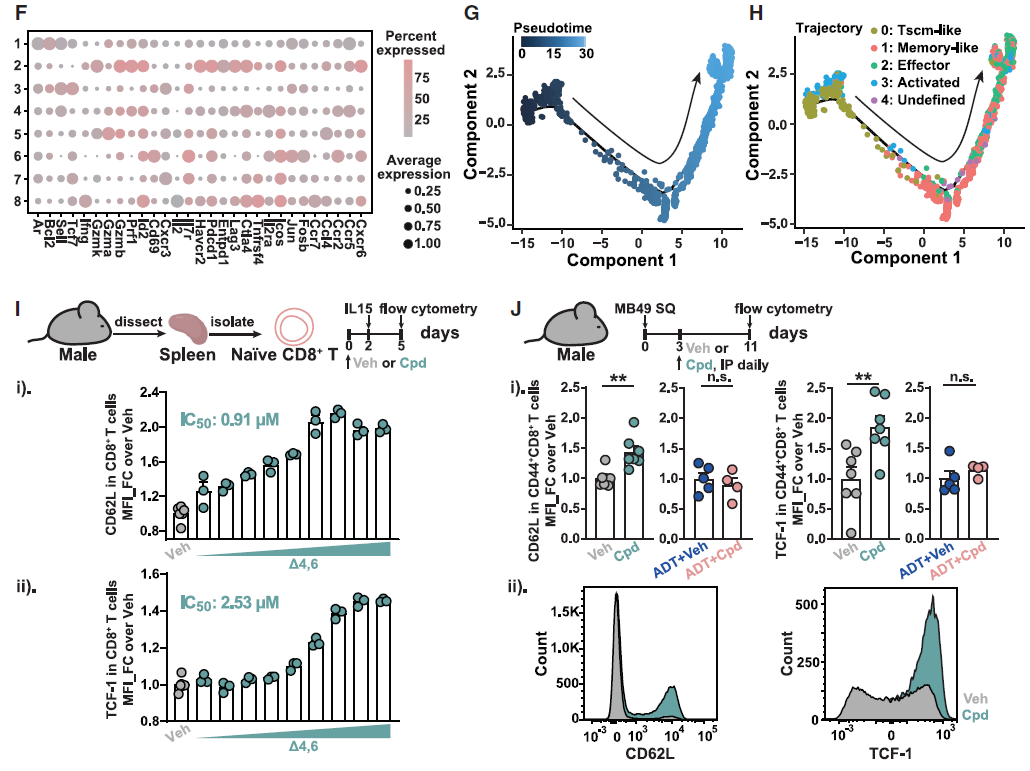
在机制方面,研究者通过细胞耗竭试验,明确了CD8+T细胞是必需效应细胞。随后分选出肿瘤浸润的 CD8+T细胞进行单细胞转录组测序,发现AR在其中一簇干细胞样记忆T细胞(Tscm)中的表达水平最高,发育轨迹分析则进一步表明,在3-oxo-D4,6-LCA诱导下,这簇Tscm细胞可分化为效应T细胞。
图6. 3-oxo-D4,6-LCA促进Tscm样CD8+T细胞的分化
以上结果表明,AR拮抗胆汁酸通过调控CD8+T细胞的干性程序而非直接杀伤肿瘤细胞,从而发挥抗癌作用。
5.AR拮抗胆汁酸的临床应用潜能
最后,研究者探讨了AR拮抗胆汁酸在人类中的功能保守性和临床相关性。体外实验显示,3-oxo-D4,6-LCA可诱导人类幼稚CD8+T细胞转变为Tscm表型,与小鼠的单细胞转录组测序结果一致,表明其在跨物种间功能保守。临床样本分析发现,血清中 AR 拮抗胆汁酸浓度与前列腺特异性抗原(PSA,一种前列腺癌标志物)呈显著负相关,而PSA是AR信号调控的下游指标,提示微生物群衍生的AR拮抗胆汁酸可能通过抑制AR信号影响PSA水平。这些结果为雄激素依赖性肿瘤(如前列腺癌)的免疫治疗提供了新靶点,也为 “微生物群-AR轴” 在人类疾病中的潜在应用奠定了基础。
全文总结
本研究通过整合胆汁酸代谢组学和微生物遗传学,鉴定出56种肠道菌群衍生的新型异构型胆汁酸,其中部分是人类雄激素受体(AR)的强效拮抗剂,能够抑制AR相关基因表达,且与人类的生理相关。此外,该研究证实其中一种胆汁酸:3-oxo-D4,6-LCA,可通过依赖AR的方式抑制肿瘤进展,并增强抗PD-1治疗的疗效。
参考文献
Jin WB, Xiao L, Jeong M, et al. Microbiota-derived bile acids antagonize the host androgen receptor and drive anti-tumor immunity. Cell. 2025
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱公司的经典胆汁酸产品已协助数千家合作单位开展肝病、肠病、心血管疾病、糖尿病、肥胖、衰老、肿瘤/癌症、畜牧动物、中药等领域功能研究,已发表项目文章100+篇,其中大于10分的50+篇,涵盖Cell Metabolism, Nature Metabolism, Nature Communications, Nature Aging, Advanced Science, Microbiome, Science Advances等期刊。近期公司的原研新品【胆汁酸全新修饰谱】检测项目重磅发布(点击查看介绍),有望助力临床医生和科研人员深入挖掘新型修饰胆汁酸的巨大临床功能价值,助您的成果更上一层楼,圆梦顶刊!