粪便样本的运输
临床上收集粪便样本,可能会碰到病人在自己家中采集粪便的情况。此时,如何将粪便运送至医院是需要考虑的事情。如下图所示,相比于5h、10h和24h,粪便在室温和冷藏条件下放置1h,其代谢轮廓与新鲜粪便更为接近。但单独比较新鲜粪便和放置1h后的粪便时可发现,室温可致乙酸和戊酸含量显著升高,而琥珀酸和富马酸含量显著降低。冷藏存储则较为稳定,其代谢物和新鲜粪便无明显差异[1]。因此,患者在家中采集的新鲜粪便需置于冰上,并在1-2小时之内送至医院。
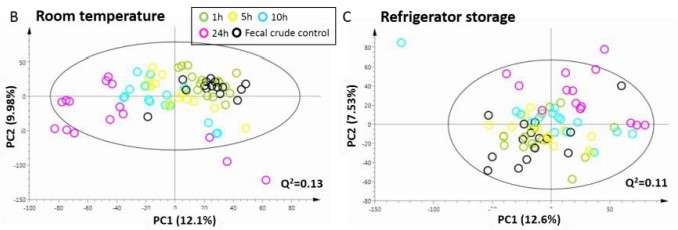
图2. 室温和冷藏不同时间的PCA图
临床上收集粪便样本,可能会碰到病人在自己家中采集粪便的情况。此时,如何将粪便运送至医院是需要考虑的事情。如下图所示,相比于5h、10h和24h,粪便在室温和冷藏条件下放置1h,其代谢轮廓与新鲜粪便更为接近。但单独比较新鲜粪便和放置1h后的粪便时可发现,室温可致乙酸和戊酸含量显著升高,而琥珀酸和富马酸含量显著降低。冷藏存储则较为稳定,其代谢物和新鲜粪便无明显差异[1]。因此,患者在家中采集的新鲜粪便需置于冰上,并在1-2小时之内送至医院。

图2. 室温和冷藏不同时间的PCA图
从下图中可以看出[1],粪便收集器中不同位置取出的局部粪便样品和整体匀浆后的粪便样本(绿色)在PCA得分图上有较为明显的分布差异,且这种差异在不同个体之间是不一致的。相比于代谢物组,不同位置获得的菌群测序结果却差异不明显,为了方便存储,显然不可能把所有收集到的新鲜粪便冻存。因此,临床上冻存收集的新鲜粪便之前,需用无菌棒将样品混匀。
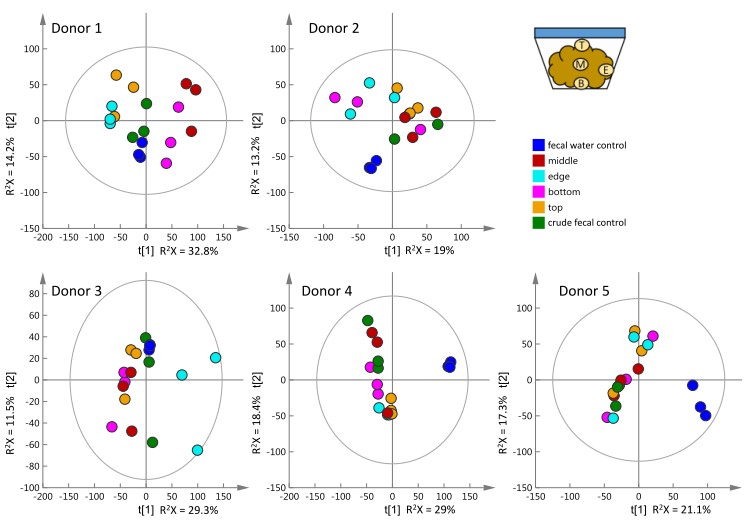
图1. 粪便不同部位代谢轮廓PCA图
环境温度及变化均会对生物体内的小分子代谢物产生影响。若将超低温冰箱或液氮中的生物样本直接放置到室温环境,代谢物氧化降解或代谢酶活性恢复的时间差异,会引起代谢物组成和浓度的变化。因此,代谢组学样本的解冻需要在冰浴上缓慢进行。
代谢组学样品应尽量避免反复冻融。Helen等人发现尿液经过九次冻融后,其代谢轮廓的差异相比个体差异(相同颜色代表同一个体)要小(图5)[10]。另一篇报道也发现冻融对生物样本的影响并没有我们想象的那么大,但对临床样本而言会有个体差异[6]。某些个体的样品较为稳定,而有些个体的样品即使经过一次冻融,其代谢轮廓也会发生剧烈波动(图6 A&B)。另外,不同代谢物种类对冻融的敏感度也不同,如肉碱经过两次冻融后,其浓度显著降低(图6 C)。因此,我们建议在存储前有计划地将样品提前分装好,尽量避免反复冻融。生物样本冻融不超过六次为宜,且需在低温下缓慢解冻。
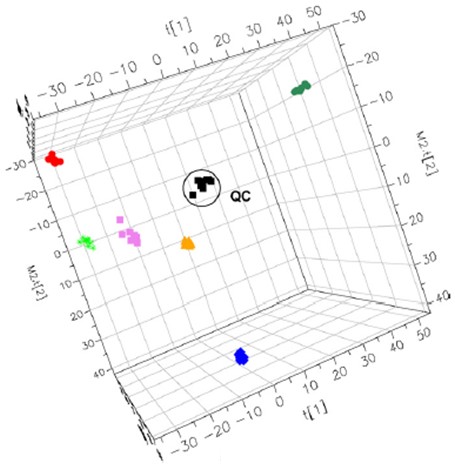
图5. 六个临床尿液样品反复冻融九次后的PCA得分图。

图6. 冻融对代谢轮廓的影响。
样品长期存储于液氮中是最理想的存储方式,但是需要不断补充液氮,操作成本高。实验室中最常见的存储方式是-20℃和-80℃冰箱。那么这两种方式会对代谢物产生怎样的影响?Helen等对比了在-20 ℃和-80 ℃存储不同时间下生物样本中代谢物的稳定性[10]。如下图所示,经过长达6个月的存储以后,-20℃和-80℃存储的样品整体代谢轮廓较没有明显差异,且和收集当天较为类似。但部分代谢物如蛋氨酸、B族维生素、DHA和EPA在-20℃下存储3个月以上会发生显著降解[11,12]。因此,推荐将样品存储于-80℃冰箱,并尽快送检。如果检测物质是易挥发、易氧化降解的,建议开展预实验。
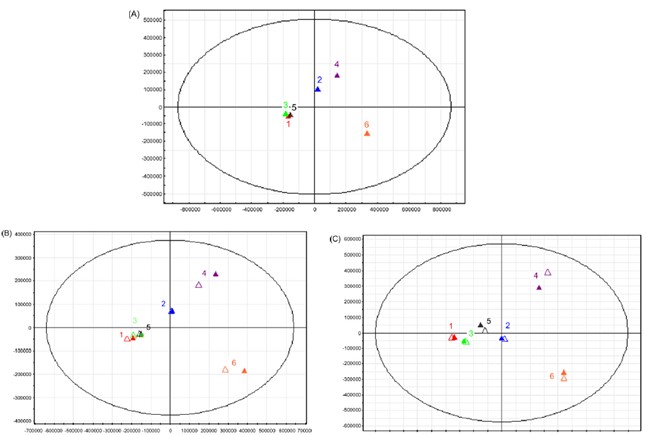
图. 尿液样品PCA得分图。A:收集当天;B:1个月后;C:6个月后。空心的为负80度存储,实心的为负20度存储。
尿样收集具有无创和易于获得的优点,被广泛应用于代谢组学研究。由于尿液中细菌生长迅速,有些研究会在尿液中添加如硼酸和叠氮化钠等抑菌剂保护尿液样本不被污染。但这些外来化学试剂的添加不可避免地会对尿液中的代谢物产生不利影响[7]。抑菌剂并不能完全去除掉细菌,选择离心加微孔滤膜过滤的方式更佳[8]。另外,尿液样品在低于-25℃条件下储存时,添加抑菌剂和不加抑菌剂,样品的代谢轮廓没有差异[9]。因此,我们不建议在尿液样品中添加如叠氮化钠等抑菌剂。
血浆是血液经抗凝、离心除去血细胞后得到的淡黄色液体。常用的抗凝剂有柠檬酸、EDTA和肝素盐等。其中,柠檬酸和EDTA是通过钙离子鳌合作用而抗凝,而肝素是通过激活抗凝血酶,抑制凝血因子而抗凝。代谢组学项目一般不建议选择柠檬酸作为抗凝剂,因为柠檬酸是机体内重要代谢通路——三羧酸循环的中间产物。而EDTA在NMR上会产生很强的噪音信号[5]。那肝素盐是否就是最佳的抗凝剂选择?有多篇报道表明肝素盐抗凝管会在液质上产生严重的干扰信号[2, 6],如下图3所示,经鉴定,这些干扰是聚乙烯醇的信号,可能来自于抗凝管中的塑料。因此,若选择质谱作为代谢组学检测平台,我们推荐EDTA作为血浆抗凝剂。
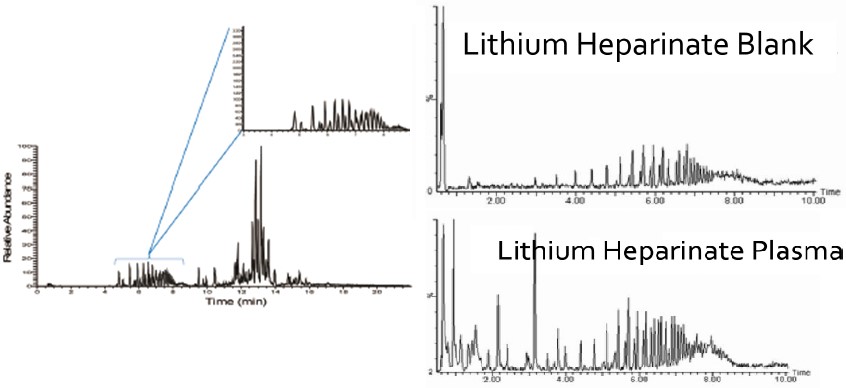
图3. 肝素锂抗凝血浆的液质色谱图。
目前已被公认的事实是血清和血浆的代谢轮廓存在很大差异。如下图1所示,无论是液质平台(正负离子检测模式,图1-A,B),还是气质平台(下图1-C,D),血清和血浆样本在PCA等模型得分图上都有明显区分[2, 3]。相比于血浆,血清中溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、氨基酸和葡萄糖等代谢物显著升高,而丙酮酸、柠檬酸、尿酸和磷脂酰肌醇则显著降低[4]。因此,对于一个研究项目来说,我们只能选择同一种类型的样本。另外,从图1-D中我们可以发现,血清和血浆的代谢轮廓会随着孵化时间的不同而改变。这提示我们要确保样本收集过程的一致性。血清样本由于需要时间去凝结,尤其需要注意尽可能保证所有样品凝血时间的一致性。

图1. 血清和血浆样品PCA(A,B,C)和PLS-DA(D)得分图。
代谢组学关注的是不同个体间代谢轮廓的差异性。那么,血清和血浆的巨大差异是否会影响个体间的代谢轮廓?下图是将血清和血浆分别作PCA得分叠加图,从图上可以看出个体间的相对位置较为类似。对血清和血浆样本得分值作Mantel test,ESI+和ESI-模式下的相关性分别为0.72和0.88[2]。因此,血清和血浆样本均可以应用于代谢组学,但找出的差异生物标志物会有细微的区别。
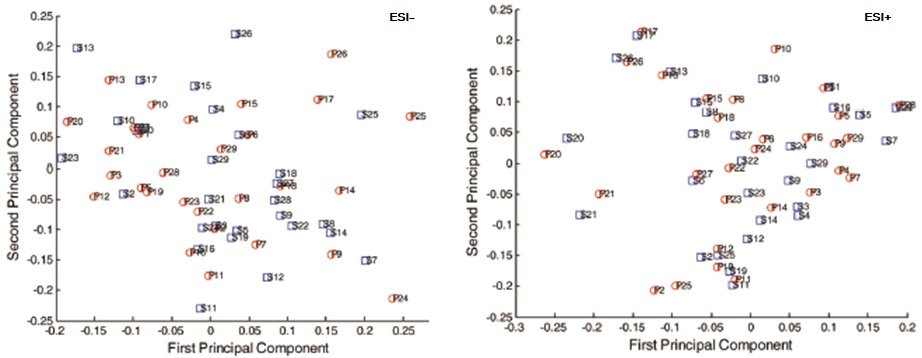
图2. 血清和血浆样品分别作PCA后的叠加得分图。